Cerebral arteriovenous
malformation
malformation
脳動静脈奇形
準備&コンセプト
脳動静脈奇形(以下、AVMと言う)治療戦略において、定位放射線手術(SRS)の担う役割は大きく、とくにスペッツラー分類3以上のAVMに対して血管内治療との組み合わせ、もしくは箇所分割による段階的照射にて対応可能としている。
私たちは通常、3D CTA原画像、MRI条件3-4 sequences(T2SE axial 2.0 mm slices/ TOF axial 1.0 mm slices/ gadolinium(Gd)enhanced TOF axial 1.0 mm slicesを基本とし、さらにAVMが視神経や海綿静脈洞周囲に存在する場合はGd enhanced CISS/FIESTA axial 0.5-1.0mm slicesを追加している)、及びDSA(脳血管撮影検査)を全症例に対してルーチンで撮像。その後、ブレインラボ社・ヴァスキュラー・エレメンツにインストール。その上で、DSAとCT/MRIの合成画像作成後、照射ターゲットを確定。次いで、治療計画用コンピュータへデータ転送し、照射計画の準備を行う。その詳細は以下に記述する。
私たちは通常、3D CTA原画像、MRI条件3-4 sequences(T2SE axial 2.0 mm slices/ TOF axial 1.0 mm slices/ gadolinium(Gd)enhanced TOF axial 1.0 mm slicesを基本とし、さらにAVMが視神経や海綿静脈洞周囲に存在する場合はGd enhanced CISS/FIESTA axial 0.5-1.0mm slicesを追加している)、及びDSA(脳血管撮影検査)を全症例に対してルーチンで撮像。その後、ブレインラボ社・ヴァスキュラー・エレメンツにインストール。その上で、DSAとCT/MRIの合成画像作成後、照射ターゲットを確定。次いで、治療計画用コンピュータへデータ転送し、照射計画の準備を行う。その詳細は以下に記述する。
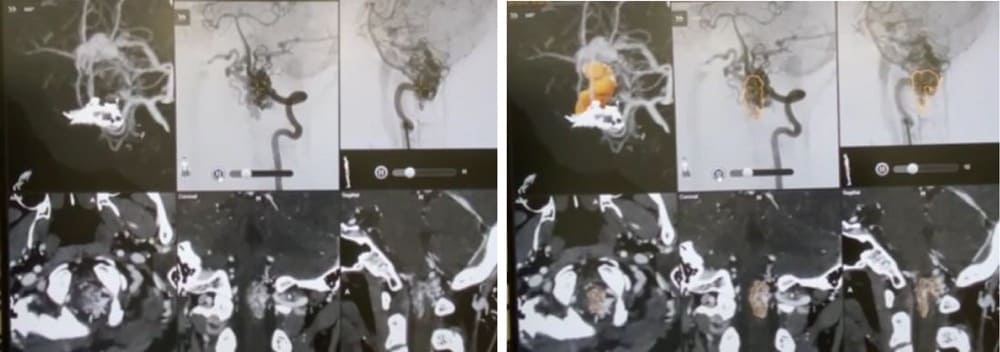
ブレインラボ社・ヴァスキュラー・エレメンツ
における照射ターゲット確定
における照射ターゲット確定
上図におけるブレインラボ社ソフトにてDSAとMRIおよびMRA画像をco-registration(左)。その後、DSAにおいても動脈相~毛細血管相~静脈相と連続しつつ、その後、MRIとco-registrationを施したと正確に対応しながら、最終的に照射ターゲットを設定(右図/橙色箇所)。その際、リアルタイムに照射ターゲット体積が自動的に計算されるようになっている(後述するが、私たちは一回のSRS治療において、同体積が4.0cc以下となるよう推奨している)。
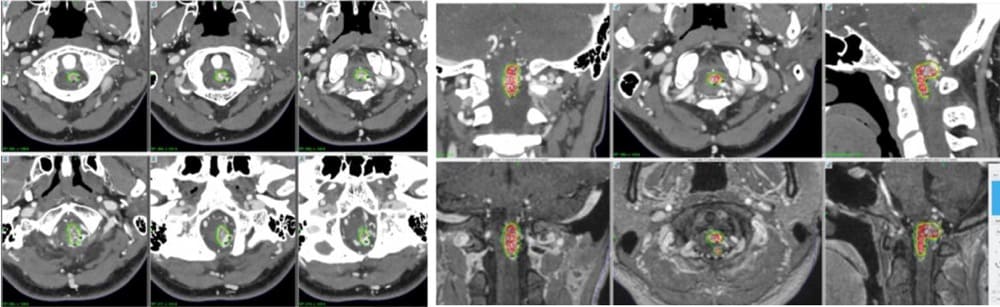
エレクタ社・治療計画用コンピュータにおける線量計画
次いで、ブレインラボ社ソフトにて確定した照射ターゲットデータを治療計画用コンピュータへ転送。その後、主に3DCTA原画像を用いながら、確定された照射ターゲットを余すことなく囲うべく8mm径のアイソセンター(球状照射野)を配置し、照射体積計算を適宜行いながら、最終的に至適辺縁線量(Gy)と辺縁線量域(isodose %)を確定し照射加療を行っている。
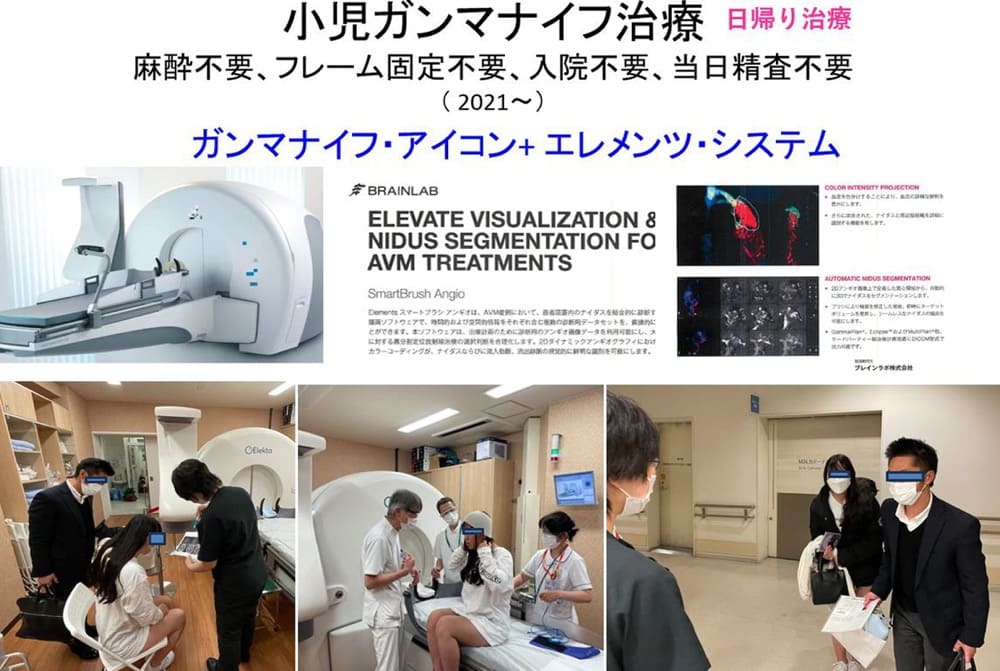
従来は、治療当日にフレームアプリケーションの元、DSAを行うことが必須であったが、私たちはブレインラボ社ソフトを使用することで、施設は問わず事前に施行されたDSAデータを元に治療計画が遂行できることから当日不要となり、痛いフレーム固定も、苦痛なDSAも、もちろん静脈麻酔やお子さんの全身麻酔も必要なく「日帰り治療」を可能としている。
従来は、治療当日にフレームアプリケーションの元、DSAを行うことが必須であったが、私たちはブレインラボ社ソフトを使用することで、施設は問わず事前に施行されたDSAデータを元に治療計画が遂行できることから当日不要となり、痛いフレーム固定も、苦痛なDSAも、もちろん静脈麻酔やお子さんの全身麻酔も必要なく「日帰り治療」を可能としている。
実際
&ピットホール

私たちが行うSRS
 つの基本ステップとピットホール
つの基本ステップとピットホール
Priority targetはドレーナー(導出静脈)に移行するナイダスとしている
照射ターゲットは真のナイダスであり、ドレーナー及び周囲に存在している拡張正常血管(Moja Moja vessels)は可能な限り照射野には入れない
辺縁線量は最低22Gyとし、かつ照射体積は4.0cc以下とする
辺縁線量域のisodoseは基本50%を用いるが、もし照射体積が4.0cc以上となってしまった場合、脳腫瘍治療と異なり55-60% isodoseを用い相似形に照射野を狭め4.0cc以下となったところで当該治療線量域isodose lineを確定する
脳腫瘍治療とは異なり、照射野内の線量勾配均一性は意識しない。むしろ、ドレーナーの一部が内部に存在する場合は、同部へ高線量域(80% isodose area)が当たらないよう工夫する
照射体積4.0ccにて、残存ナイダスが明らかに存在する場合、3年後を目途に同部の追加治療を考慮する
とくにグレード3以上のAVM治療に対して、ナイダスのpriority target箇所は世界各施設において戦術が異なる(主に4法:フィーダー側、コンパートメント毎、ドレーナー側、そしてno policy)。私たちは、病理組織学的に有意な箇所、つまりmain shunting箇所としてのドレーナー側ナイダスをpriority targetとしている。同部は外科摘出の観点では禁忌とされる箇所であり、20年前は多くの脳神経外科医より罵声を浴びていた。しかし、高線量一括照射による血管内被細胞の病理学的変化は非常に遅く、一般的には3年かけて閉塞へと至る。

そこが外科摘出と異なり、急に脳内血流変化は惹起されないのが特徴であり、それを証拠にこの20年間における照射後出血率は1%台であり、自然出血率と比較しても有意に低値であることから、禁忌というレッテルは無くなった。むしろ、SRSはAVMを消失させる治療ではなく、脆弱なナイダスを内側からまるで耐震補強して出血しづらくさせる治療と私たちは捉えている。よって、例え画像上消失しなかったとしても、十分な照射がなされた箇所であれば出血リスクは極めてゼロに近いものと考えている。
治療効果の点において、マルセイユ大学レジス教授(脳神経外科)によれば、AVMの状況状態(例えばhigh flowなど)に問わず、22GyがAVM完全消失に必要な辺縁線量であると提唱されている。さらに、安全性の点において、ピッツバーグ大学フリキンジャー教授(医学物理)らによれば、dose-volume effect(線量体積効果)において、辺縁線量22Gyにおける周囲正常脳被爆による副作用(脳浮腫・放射線壊死)回避の観点から、照射体積は4.0cc以下とすべきと算出されている(体積1.0cc以下の場合は24Gy)。それを証拠に帰国後20年の間で放射線障害を起こした患者はゼロである(一方で、全体の25%に治療後半年前後で浮腫性変化をMRI上認めている。これは放射線障害ではなく、ナイダス早期閉塞に伴う贅沢還流と考えており、ほとんどの症例で改善完治している)。
上述のごとく、本治療はナイダス内の血管壁の厚みを増し、さらに内腔が狭小化することで血流が減ずることが一番の目的となっている。血流低下により、術後経過の中でMoja Moja vessels(周囲拡張正常血管)は自然消失していくので照射の必要はない。ドレーナーへの過照射により、遅発性贅沢還流を来す可能性が稀ならずあり、その際は程度は弱くても出血するリスクが上がるので注意を要する。また、小児例の場合、成人例と異なり、SRSに対するナイダスの感受性が強く、私たちの治療法(ドレーナー側ナイダス/4.0cc&22Gyルール)においては段階的照射を予定していても完治してしまうケースが少なくない。その理由として、未照射箇所内血流が経時的に減ぜられ、同部に血栓形成を起こしてしまうことが推測されている。だからこそ、人生のある小児例では、悪性脳腫瘍の晩発性発症(0.1%程度)を回避するためにも、正常脳被爆を最大限避け得る必要があると私たちは考えている。
治療効果の点において、マルセイユ大学レジス教授(脳神経外科)によれば、AVMの状況状態(例えばhigh flowなど)に問わず、22GyがAVM完全消失に必要な辺縁線量であると提唱されている。さらに、安全性の点において、ピッツバーグ大学フリキンジャー教授(医学物理)らによれば、dose-volume effect(線量体積効果)において、辺縁線量22Gyにおける周囲正常脳被爆による副作用(脳浮腫・放射線壊死)回避の観点から、照射体積は4.0cc以下とすべきと算出されている(体積1.0cc以下の場合は24Gy)。それを証拠に帰国後20年の間で放射線障害を起こした患者はゼロである(一方で、全体の25%に治療後半年前後で浮腫性変化をMRI上認めている。これは放射線障害ではなく、ナイダス早期閉塞に伴う贅沢還流と考えており、ほとんどの症例で改善完治している)。
上述のごとく、本治療はナイダス内の血管壁の厚みを増し、さらに内腔が狭小化することで血流が減ずることが一番の目的となっている。血流低下により、術後経過の中でMoja Moja vessels(周囲拡張正常血管)は自然消失していくので照射の必要はない。ドレーナーへの過照射により、遅発性贅沢還流を来す可能性が稀ならずあり、その際は程度は弱くても出血するリスクが上がるので注意を要する。また、小児例の場合、成人例と異なり、SRSに対するナイダスの感受性が強く、私たちの治療法(ドレーナー側ナイダス/4.0cc&22Gyルール)においては段階的照射を予定していても完治してしまうケースが少なくない。その理由として、未照射箇所内血流が経時的に減ぜられ、同部に血栓形成を起こしてしまうことが推測されている。だからこそ、人生のある小児例では、悪性脳腫瘍の晩発性発症(0.1%程度)を回避するためにも、正常脳被爆を最大限避け得る必要があると私たちは考えている。
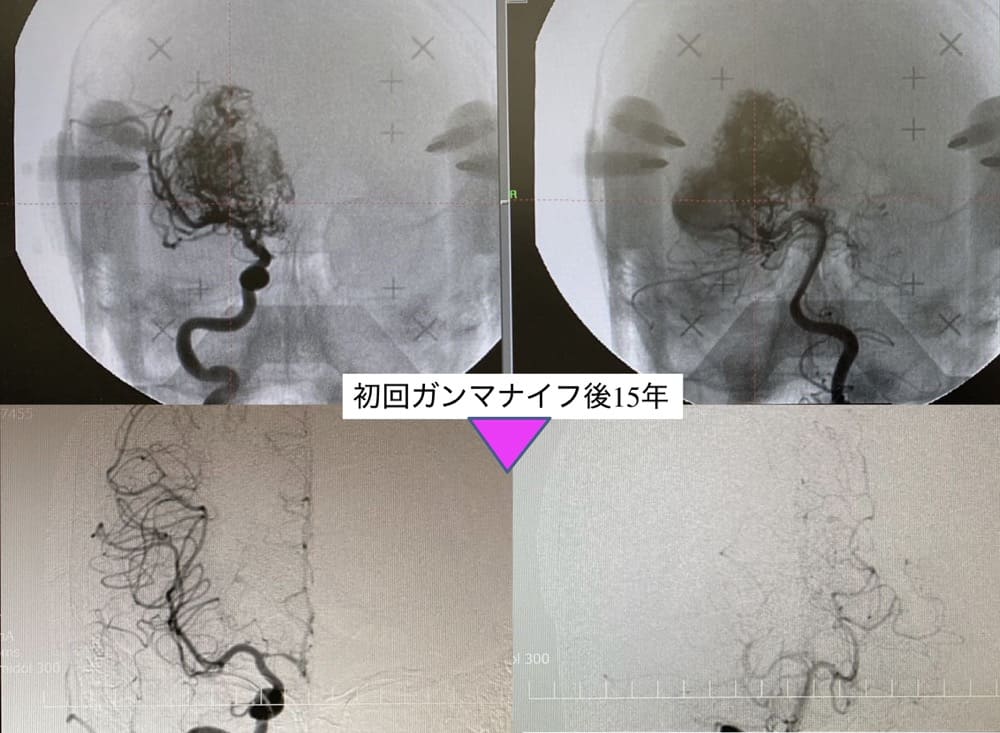
小児AVM例(SMG5/女児9歳)
右大脳基底核部に直径7センチ大の巨大AVMを認める。おそらく成長に伴い、ドレーナーが拡張した巨大静脈瘤の増大。これにより周囲内包が直接圧迫され、それに伴う緩徐進行性片麻痺の発症と考えられた。出血発症ではなかったのと、その大きさから、全体を囲んでの一回治療は不可であり、むしろナイダスおよびドレーナー内血流を有意に減ずる(flow reduction)を目論み、私たち独自の治療方法で照射加療することにした。
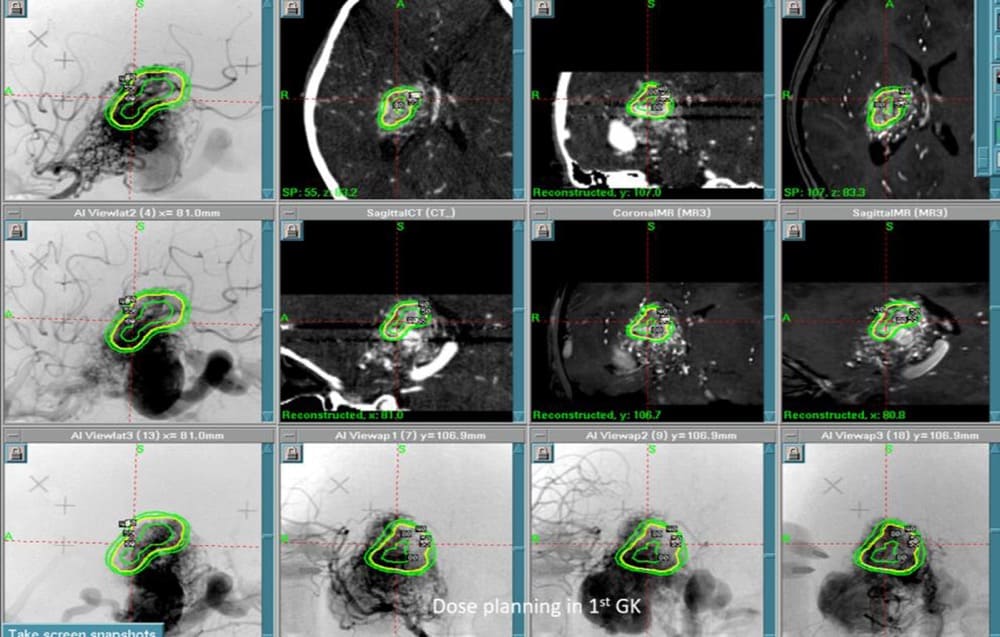
CT/MRI/DSAを同時に
表示しながらの治療計画
表示しながらの治療計画
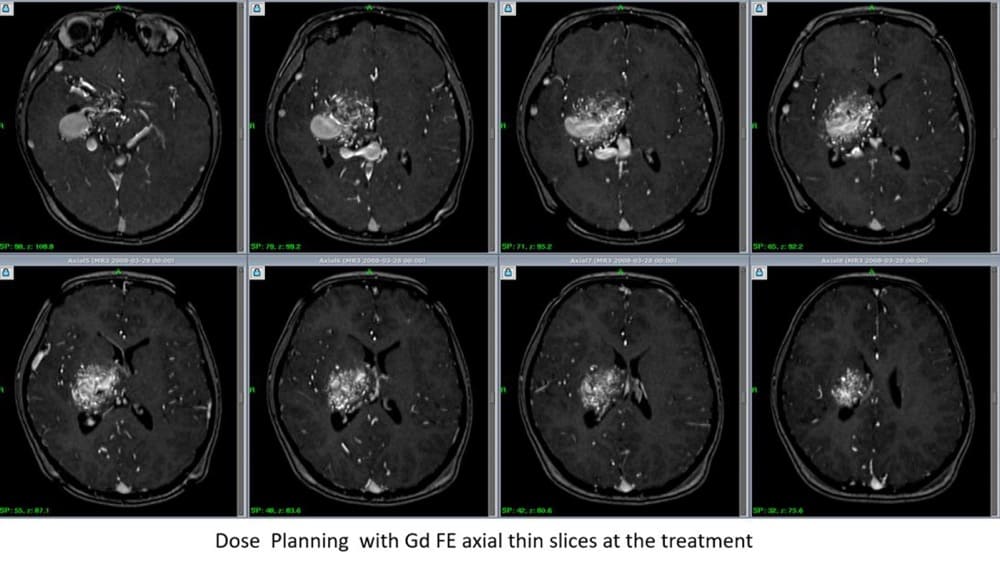
ドレーナー側ナイダスのみを4ccの照射体積にて囲い、同部に対して辺縁線量22Gyで照射加療することにした。その後1年で緩徐進行性麻痺が止まり、MRI上有意に巨大静脈瘤の縮小を認めた。また、照射野外ナイダスにも自然に血栓形成が進み、予想以上に画像上ナイダス消失を起こしていた。さらにこれらに対して順次同様方法(4cc/22Gyルール)を繰り返し、15年後に何ら後遺症なくすべてのAVMが画像上消失した。本症例治療がその後の私たちの治療の礎となり、至高の治療計画に近づく大きな経験となった。
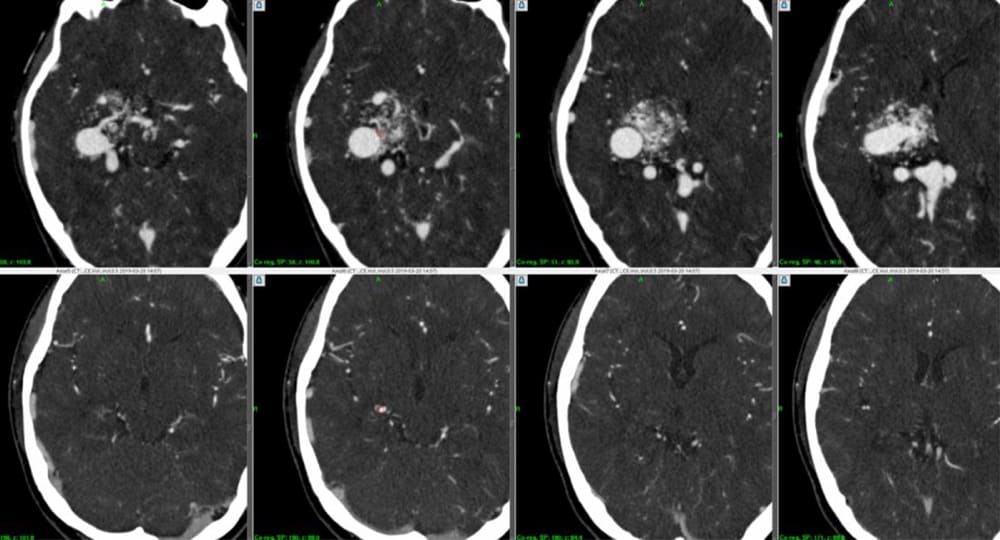
上段/初回ガンマナイフ治療前、
下段/治療後10年時の3DCTA原画像
脳浮腫などの後遺症なく、ほぼ完全消失にまで至っている
下段/治療後10年時の3DCTA原画像
脳浮腫などの後遺症なく、ほぼ完全消失にまで至っている
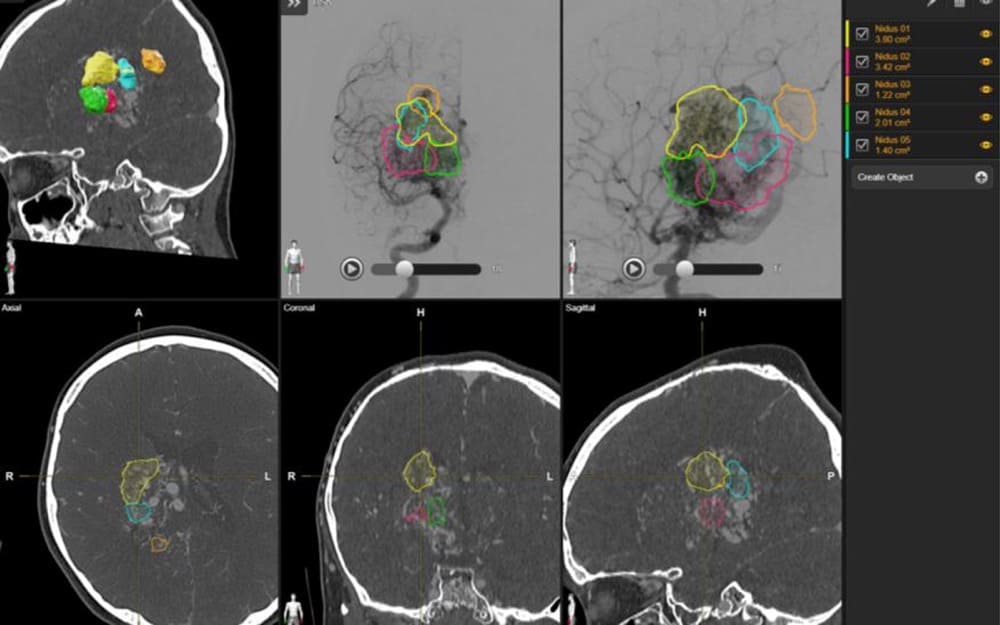
ブレインラボ社・ヴァスキュラー・
エレメンツ内画像表示
エレメンツ内画像表示
同じく右大脳基底核における巨大脳深部AVM。出血発症にて治療必要なケース。当日DSA・全身麻酔・ピン固定にて15年前に治療した9歳女児例と現在は異なり、事前DSA・MRI・CTにてブレインラボ社・ソフトを用いることで、初回治療からその先まで計画的にどのように治療していくかを決められるようになった(各色・計5回分の予定照射ターゲット)。
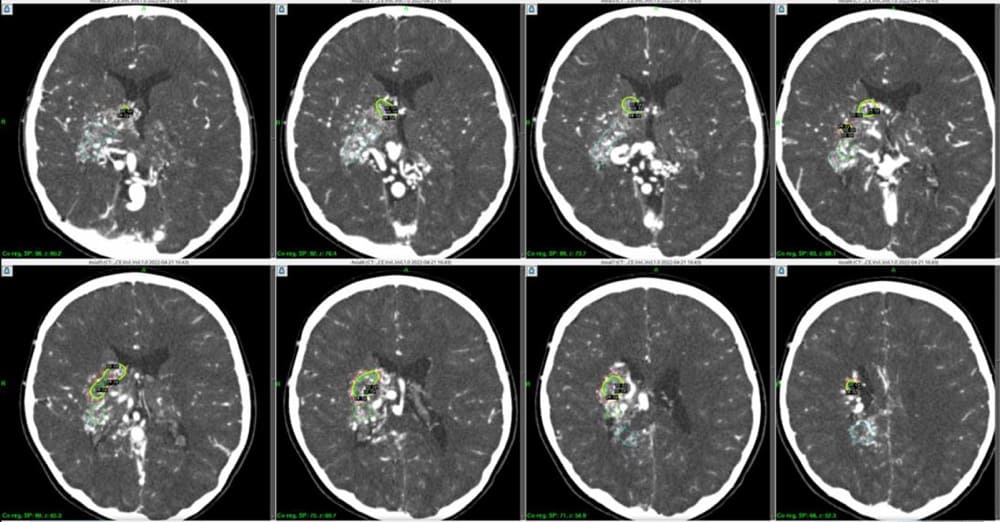
エレクタ社・治療計画用コンピュータ
における治療計画
における治療計画
初回は出血箇所であるピンク色の線で囲ったナイダスを優先照射ターゲットに定めて照射計画を作成した。治療当日は、フレームレスにてピン固定不要、DSA不要にて照射加療を日帰りにて終了した。後は外来で変化を見ながら、2-3年毎に1回のペースで無麻酔日帰り治療を予定している。
(SMG4/モンゴル人/7歳女児)
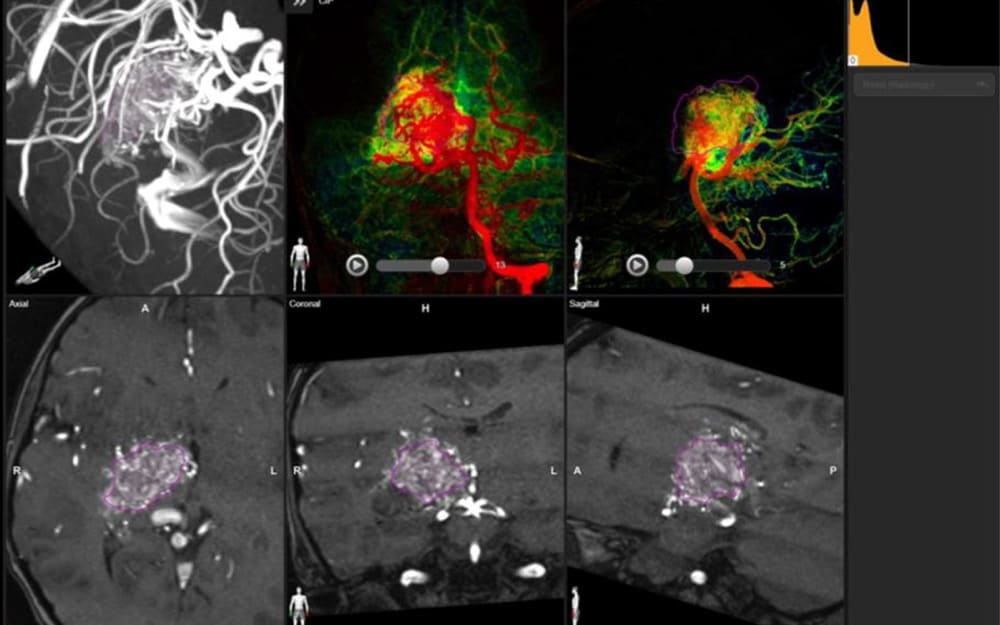
ブレインラボ社・ヴァスキュラー・
エレメンツ内画像表示
エレメンツ内画像表示
同じく右大脳基底核における大きめの脳深部AVM。出血発症にて治療必要があり、モンゴル医療施設より本学へ紹介。一方で、経済的に豊かでない一般家庭の子であったため、当院ではモンゴル医療施設で撮られていなかった3DCTA原画像のみを経済的負担を鑑み、術前検査として行うこととし、MRIやDSAは持参CDROM内の画像を用いて治療計画準備とした。
全画像をブレインラボ社・ソフトにすべてinstallおよびco-registrationを上図のごとく行った。ナイダス内流量をカラーモードで確認しながら、ナイダスを紫の囲い込みに成功。その後、上記データを治療計画用コンピュータへ転送し、その中で治療計画(4cc/22Gyルールにて)行った(下図)。治療当日は、マスク固定のみの無麻酔日帰り治療で終えた。
全画像をブレインラボ社・ソフトにすべてinstallおよびco-registrationを上図のごとく行った。ナイダス内流量をカラーモードで確認しながら、ナイダスを紫の囲い込みに成功。その後、上記データを治療計画用コンピュータへ転送し、その中で治療計画(4cc/22Gyルールにて)行った(下図)。治療当日は、マスク固定のみの無麻酔日帰り治療で終えた。
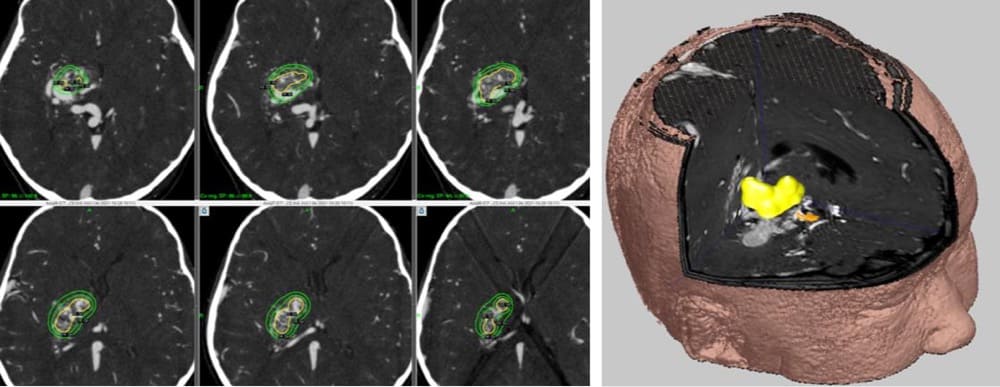
エレクタ社・治療計画用コンピュータ
における治療計画と3D画像
における治療計画と3D画像
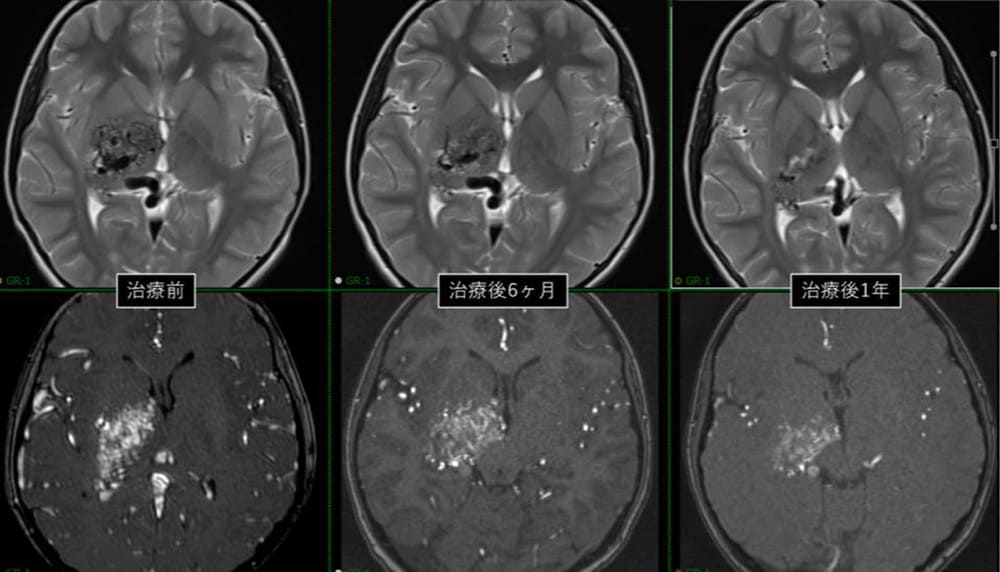
MRIによる治療後経緯
まだ治療後1年の経過ではあるが、再出血なく、放射線障害および視機能含めた神経障害なく経過しており、本国で快適に暮らしていると聞いている。